Công thức giải nhanh trắc nghiệm hóa học thi thpt Quốc gia
Làm trắc nghiệm Hóa phải đúng cùng nhanh, tốt nhất là trong những kì thi đặc biệt quan trọng như thi xuất sắc nghiệp, thi Đại học, cho nên Vn
Doc xin giới thiệu Các bí quyết giải cấp tốc trắc nghiệm hóa học. Tài liệu sẽ cung cấp cho các bạn các công thức, các mẹo cấp tốc khi làm cho trắc nghiệm môn Hóa phần hữu cơ và vô cơ.
Bạn đang xem: Công thức tính nhanh hóa hữu cơ
I. PHẦN VÔ CƠ
1. Tính lượng kết tủa mở ra khi kêt nạp hết lựơng CO2 vào dd Ca(OH)2 hoặc Ba(OH)2:
nkết tủa = n
OH- – n
CO2
(Đk: nktủa CO2)
2. Tính lượng kết tủa xuất hiện thêm khi dung nạp hết lượng CO2 vào dd chứa hỗn hợp Na
OH với Ca(OH)2 hoặc Ba(OH)2:
CO3- = n
OH- – n
CO2So sánh với n
Ba2+ hoặc n
Ca2+ nhằm xem hóa học nào phản nghịch ứng hết
(Đk: n
CO3- CO2)
3. Tính VCO2 đề xuất hấp thụ hết vào dd Ca(OH)2 hoặc Ba(OH)2 thu được lượng kết tủa theo yêu cầu:
nCO2 = nktủan
CO2 = n
OH- – nktủa
4. Tính Vdd Na
OH đề nghị cho vào dd Al3+ để xuất hiện thêm lượng kết tủa theo yêu cầu:
OH- = 3nktủan
OH- = 4n Al3+ – nktủa
5. Tính Vdd HCl buộc phải cho vào dd Na
Al
O2) để xuất hiện thêm lượng kết tủa theo yêu cầu:
H+ = nktủan
H+ = 4n
Na
6. Tính Vdd Na
OH yêu cầu cho vào dd Zn2+ để mở ra lượng kết tủa theo yêu cầu:
OH- = 2nktủan
OH- = 4n
Zn2+ – 2nktủa
7. Tính trọng lượng muối sunfat thu được lúc hoà tan hết hỗn hợp kim loại bởi H2SO4 loãng giải hòa H2:
msunfat = mh2 + 96n
H2
8. Tính khối lượng muối clorua thu được lúc hoà tan không còn hỗn kim loại tổng hợp loại bởi dd HCl giải tỏa H2:
m clorua = mh2 + 71n
H2
9. Tính khối lượng muối sunfat thu được khi hoà tung hết hỗn hợp oxit kim loại bằng H2SO4 loãng:
msunfat = mh2 + 80n
H2SO4
10. Tính trọng lượng muối clorua thu được lúc hoà chảy hết các thành phần hỗn hợp oxit kim loại bằng dd HCl:
mclorua = mh2 + 27,5n
HCl
11. Tính khối lượng muối clorua thu được lúc hoà tan không còn hỗn kim loại tổng hợp loại bằng dd HCl vừa đủ:
mclorua = mh2 +35, 5n
HCl
12. Tính trọng lượng muối sunfat thu được lúc hoà tan không còn hỗn hợp những kim loại bằng H2SO4 đặc, nóng hóa giải khí SO2:
m
Muối = mkl + 96n
SO2
13. Tính trọng lượng muối sunfat thu được lúc hoà tan hết hỗn hợp các kim loại bởi H2SO4 đặc, nóng giải hòa khí SO2, S, H2S:
m
Muối = mkl + 96(n
SO2 + 3n
S + 4n
H2S)
14. Tính số mol HNO3 cần dùng để hòa tan hỗn hợp các kim loại:
n
HNO3 = 4n
NO + 2n
NO2 + 10n
N2O + 12n
N2 + 10n
NH4NO3
Lưu ý:
Không tạo thành khí như thế nào thì số mol khí đó bởi 0.Giá trị nHNO3 không nhờ vào vào số sắt kẽm kim loại trong láo lếu hợp.Chú ý khi tính năng với Fe3+ vì chưng Fe khử Fe3+ về Fe2+ yêu cầu số mol HNO3 đã dùng làm hoà tan hỗn kim loại tổng hợp loại nhỏ tuổi hơn so với tính theo cách làm trên. Chính vì thế phải phân tích HNO3 dư bao nhiêu %.
15. Tính số mol H2SO4 đặc, lạnh cần dùng làm hoà rã 1 hỗn kim loại tổng hợp loại dựa vào SO2 duy nhất:
n
H2SO4 = 2n
SO2
16. Tính trọng lượng muối nitrat sắt kẽm kim loại thu được khi cho hỗn hợp những kim loại tính năng HNO3 (không có sự chế tác thành NH4NO3):
mmuối = mkl + 62(3n
NO + n
NO2 + 8n
N2O + 10n
N2)
Lưu ý:
Không tạo thành khí nào thì số mol khí đó bởi 0.Nếu gồm sự tạo thành thành NH4NO3 thì thêm vào đó vào mNH4NO3 gồm trong dd sau phản bội ứng. Lúc ấy nên giải theo cách cho nhận electron.Chú ý khi công dụng với Fe3+, HNO3 nên dư.
17. Tính cân nặng muối thu được lúc cho các thành phần hỗn hợp sắt và những oxit sắt tác dụng với HNO3 dư giải tỏa khí NO:
m
Muối= 242/80(mh2 + 24n
NO)
18. Tính cân nặng muối thu được lúc hoà tan không còn hỗn hợp có Fe, Fe
O, Fe2O3, Fe3O4 bởi HNO3 đặc, nóng, dư giải hòa khí NO2:
m
Muối= 242/80(mh2 + 8n
NO)
(Lưu ý: Dạng toán này, HNO3 nên dư nhằm muối nhận được là Fe(III). Không được nói HNO3 đủ vị Fe dư đang khử Fe3+ về Fe2+ :
Nếu giải phóng các thành phần hỗn hợp NO và NO2 thì bí quyết là:
m
Muối= 242/80(mh2 + 8n
NO + 24n
NO)
19. Tính khối lượng muối thu được khi hoà tan không còn hỗn hợp tất cả Fe, Fe
O, Fe2O3, Fe3O4 bởi H2SO4 đặc, nóng, dư giải tỏa khí SO2:
m
Muối= 400/160(mh2 + 16n
SO2)
20. Tính trọng lượng sắt đã dùng ban đầu, biết oxi hoá lượng fe này bởi oxi được tất cả hổn hợp rắn X. Hoà tan không còn rắn X vào HNO3 loãng dư được NO:
m
Fe= 56/80mh2 + 24n
NO)
21. Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được các thành phần hỗn hợp rắn X. Hoà tan hết rắn X vào HNO3 loãng dư được NO2:
m
Fe= 80/56(mh2 + 8n
NO2)
22. Tính VNO (hoặc NO2) chiếm được khi mang lại hỗn hợp sản phẩm sau bội nghịch ứng nhiệt nhôm(hoàn toàn hoặc không trả toàn) tính năng với HNO3:
n
NO = 1/3<3n
Al + (3x -2y)n
Fex
Oy
n
NO2 = 3n
Al + (3x -2y)n
Fex
Oy
23. Tính p
H của dd axit yếu HA:
p
H = – 1/2(log Ka + log
Ca) hoặc p
H = –log(αCa)
(Với (là độ năng lượng điện li của axit vào dung dịch. )
(Lưu ý: cách làm này đúng lúc Ca không quá nhỏ (Ca > 0, 01M)
24. Tính p
H của dd lếu láo hợp bao gồm axit yếu HA cùng muối Na
A:
p
H = –(log Ka + log Cm/Ca)(Dd trên được gọi là dd đệm)
25. Tính p
H của dd axit yếu hèn BOH:
p
H = 14 + 1/2(log Kb + log
Cb)
26. Tính công suất phản ứng tổng hợp NH3:
(Tổng hòa hợp NH3 từ láo hợp tất cả N2 và H2 với tỉ trọng mol tương ứng là 1:3)

(Với X là tỉ khối ban đầu và Y là tỉ khối sau)
(Lưu ý: % VNH3 trong Y được tính:


Dù M là kim loại nào trong những kim loại gồm hiđroxit lưỡng tính (Zn, Cr, Sn, Pb, Be) thì số mol OH- dùng để Mn+ kết tủa tổng thể sau đó tan vừa hết cũng khá được tính là:
n
OH- = 4n
Mn+ = 4n
M
28. Khẳng định kim nhiều loại M bao gồm hiđroxit lưỡng tính phụ thuộc phản ứng dd Mn+ với dd MO2n-4 (hay
Dù M là kim loại nào trong những kim loại bao gồm hiđroxit lưỡng tính (Zn, Cr, Sn, Pb, Be) thì số mol H+ dùng làm kết tủa M(OH)n xuất hiện tối đa tiếp đến tan vừa hết cũng được tính là:
n
H+ = 4n
MO2n-4 = 4n
29. Tính m gam Fe3O4 khi dẫn khí teo qua, nung nóng 1 thời gian, rồi hoà chảy hết hỗn hợp rắn sau phản bội ứng bằng HNO3 loãng dư được khí NO là duy nhất:
m = 240/232 (mx + 24n
NO)
(Lưu ý: cân nặng Fe2O3 khi dẫn khí co qua, nung nóng một thời gian, rồi hoà chảy hết hỗn hợp rắn sau làm phản ứng bằng HNO3 loãng dư được khí NO là duy nhất:
30. Tính m gam Fe3O4 lúc dẫn khí teo qua, nung nóng 1 thời gian, rồi hoà chảy hết hỗn hợp rắn sau phản bội ứng bởi H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
m = 240/232(mx + 16n
SO2)
(Lưu ý: cân nặng Fe2O3 khi dẫn khí teo qua, nung nóng một thời gian, rồi hoà rã hết hỗn hợp rắn sau bội nghịch ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
m = 160/160(mx + 16n
SO2)
II. PHẦN HỮU CƠ
31. Tính công suất phản ứng hiđro hoá nken:
Tiến hành làm phản ứng hiđro hóa anken Cn
H2n từ hỗn hợp X bao gồm anken Cn
H2n với H2 (tỉ lệ 1:1) được tất cả hổn hợp Y thì năng suất hiđro hoá là:
H% = 2 – 2 My/Mx
32. Tính năng suất phản ứng hiđro hóa anđehit solo chức no:
Tiến hành phản ứng hiđro hóa anđehit 1-1 chức no Cn
H2n
O từ tất cả hổn hợp hơi X có anđehit Cn
H2n
O và H2 (tỉ lệ 1:1) được tất cả hổn hợp hơi Y thì hiệu suất hiđro hoá là:
H% = 2 – 2 Mx/My
33. Tính % ankan A tham gia phản ứng tách(bao bao gồm phản ứng đề hiđro hoá ankan và phản ứng cracking ankan:
Tiến hành bội phản ứng tách bóc ankan A, phương pháp C2H2n+2 được hỗn hợp X bao gồm H2 và những hiđrocacbon thì % ankan A đã phản ứng là:
A% = MA/MX – 1
34. Khẳng định công thức phân tử ankan A dựa vào phản ứng bóc tách của A: tiến hành phản ứng bóc V(l)
MA =

35. Tính số đồng phân ancol đối kháng chức no:
Số đồng phân ancol Cn
H2n+2O = 2n-2 (1 n
H2n
O = 2n-3 (2 n
H2n
O2 = 2n-3 (2 n
H2n
O2 = 2n-2 (1 n
H2n
O =

H2n
O =

H2n +3N = 2n-1 (n 2 trong phản ứng cháy:
Giả sử đốt cháy hoàn toàn 1 mol ancol no, mạch hở A, phương pháp Cn
H2n +2Ox đề xuất k mol thì ta có:
n =

44. Tính trọng lượng ancol đối kháng chức no (hoặc tất cả hổn hợp ancol đối chọi chức no) theo khối lượng CO2 và trọng lượng H2O:
mancol = m
H2O –

(Lưu ý: khối lượng ancol đơn chức (hoặc hỗn hợp ancol đối kháng chức no) còn được tính:
mancol = 18n
H2O – 4n
CO2
Một số đề thi không giống mời các bạn tham khảo:
Mời gia nhập Thi và tải đề thi THPT non sông MIỄN PHÍ
Link đề thi trực tuyến:
| Môn Văn | Môn Lý | Môn Hóa | Môn Sinh | Môn Anh |
| Link thi demo miễn phí | Link thi demo miễn phí | Link thi thử miễn phí | Link thi demo miễn phí | Link thi demo miễn phí |
Link tải tài liệu thi test THPT quốc gia 2019 MIỄN PHÍ:
| Đề thi demo THPT quốc gia môn Toán | Đề thi thử THPT giang sơn môn đồ gia dụng lý | Đề thi test THPT nước nhà môn Hóa học | Đề thi thử THPT non sông môn Sinh học |
| Đề thi thử THPT tổ quốc môn Ngữ văn | Đề thi test THPT đất nước môn kế hoạch sử | Đề thi thử THPT nước nhà môn Địa lý | Đề thi demo THPT đất nước môn tiếng Anh |
Mời các bạn tải file không thiếu về tham khảo!
Để xem với tải toàn thể tài liệu các công thức giải nhanh trắc nghiệm hóa học đầy đủ chi tiết nhất mời chúng ta ấn link TẢI VỀ phía dưới.
Trên đây Vn
Doc đang gửi tới bạn đọc những công thức giải nhanh trắc nghiệm Hóa học. Văn bản tài liệu là những công thức được tính nhanh của chất hóa học giúp các bạn đọc dễ ợt áp dụng áp dụng vào những bài tập nhanh và đúng chuẩn nhất. Mời bạn đọc xem thêm mục Giải bài xích tập Hóa 12, Giải bài xích tập Toán lớp 12, Giải bài xích tập trang bị Lí 12 ,....
Lý thuyết hoá hữu cơ không ít vì vậy phần bài xích tập cũng khá đa dạng. Để những em làm xuất sắc các dạng bài bác tập phần hóa hữu cơ, loài kiến Guru cung cấp cho các em Các cách làm hoá học lớp 11 để góp giải nhanh việc hiđrocabon.

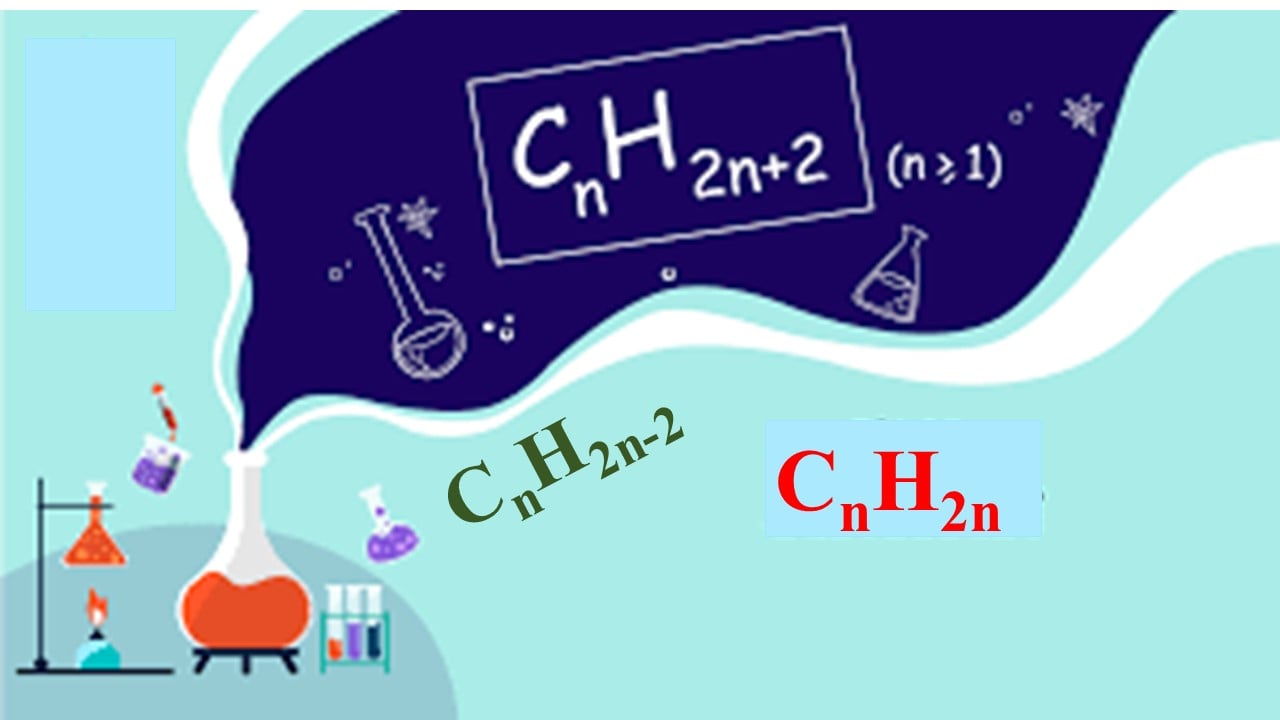
I. Các công thức hoá học tập lớp 11: Toán đốt cháy Hidrocacbon
- Công thức tổng quát của một hiđrocabon (HC): Cx
Hy (x, y nguyên dương) hoặc
Cn
H2n + 2 -2k cùng với k là số links π và vòng vào hiđrocabon.
- Công thức tính số π + v: π + v =
- Phương trình đốt cháy:
- phụ thuộc vào số mol CO2 và H2O sau phản nghịch ứng ta có thể xác định được các loại hợp chất.
Quan hệ mol CO2 cùng H2O | Loại hiđrocabon | Phương trình |
Ankan | ||
Anken | ||
Ankin, Ankađien | ||
Đồng đẳng benzen |
- Các định hiện tượng bảo toàn thường sử dụng:
+ Bảo toàn khối lượng:
+ Bảo toàn nguyên tố:
Bảo toàn C: | |
Bảo toàn H: | |
Bảo toàn O: |
(trong nhân tố phân tử chỉ chứ C với H).
- phương pháp tính số C, số H:
+ Số C =
+ Số H =
- Đối với những bài toán đốt cháy hỗn hợp 2 hiđrocabon thì:
+ trọng lượng mol trung bình:
hoặc hoặc
+ Số Ctb =
Lưu ý: khi số C mức độ vừa phải là số nguyên (bằng trung bình cộng của 2 số nguyên tử C) thì số mol 2 chất bởi nhau.
- Bài toán áp dụng hỗn hợp sản phẩm để tiếp tục cho thâm nhập phản ứng:
+ Dẫn sản phẩm cháy qua bình (1) đựng P2O5, H2SO4 đặc, Ca
O, muối khan,.... Rồi dẫn qua bình 2 đựng hỗn hợp bazơ như Na
OH, Ca(OH)2,...
mbình 1 tăng = m
H2O (hấp thụ nước)
mbình 2 tăng = m
CO2 (hấp thụ CO2).
+ Dẫn toàn bộ sản phẩm cháy trải qua bình đựng hỗn hợp bazơ như Na
OH, Ca(OH)2,...
mbình tăng = m
CO2 + m
H20 (hấp thụ cả CO2 cùng nước).
+ cân nặng dung dịch tăng: m dd tăng = m
CO2 + m
H20 – m kết tủa .
+ trọng lượng dung dịch giảm: m dd sút = m kết tủa – (m
CO2 + m
H20 ).
+ Lọc bỏ kết tủa, đun sôi dung dịch lại chiếm được kết tủa nữa:
PT:
Các cách làm hoá học lớp 11
II. Những công thức hoá học lớp 11: Tính số đồng phân Hidrocacbon
1. Đồng phân ankan:
- CTTQ: Cn
H2n+2 (n ≥ 1)
- Ankan chỉ tất cả đồng phân mạch cacbon với từ C4 trở đi mới bao gồm đồng phân.
- cách làm tính nhanh:
2. Đồng phân anken:
- CTTQ: Cn
H2n (n ≥ 2).
- Anken bao gồm đồng phân mạch C, đồng phân địa điểm nối đôi và đồng phân hình học.
- Mẹo tính cấp tốc đồng phân anken:
Xét 2C có nối đôi, từng C sẽ liên kết với 2 nhóm nạm (giống hoặc khác nhau).
Ví dụ với C4H8: Trừ đi 2C mang nối đôi sẽ còn 2C với H nhóm thế.
Nếu đề bài yêu mong tính đồng phân cấu trúc sẽ là: 1+1+1=3 đồng phân. Giả dụ yêu ước tính đồng phân (bao bao gồm đồng phân hình học) sẽ là 1+1+2=4 đồng phân.
3. Đồng phân ankin:
- CTTQ: Cn
H2n-2 (n ≥ 2).
- Ankin bao gồm đồng phân mạch C, đồng phân địa chỉ nối cha và không tồn tại đồng phân hình học.
- Mẹo tính cấp tốc đồng phân ankin:
Xét 2C có nối ba, mỗi C đã liên kết với một nhóm núm (giống hoặc khác nhau).
Ví dụ với C4H6: Trừ đi 2C sở hữu nối bố sẽ còn 2C và H là đội thế.
Ta có 2 đồng phân ankin.
4. Đồng phân benzen:
- CTTQ: Cn
H2n-6 (n ≥ 6).
Xem thêm: 50+ bài thơ về tết nguyên đán cho trẻ mầm non hay và ý nghĩa nhất
- công thức tính số đồng phân:
5. Đồng phân ancol:
- CTTQ của ancol no, đơn chức, mạch hở: Cn
H2n+1OH tốt Cn
H2n+2O (n ≥ 1).
- Ancol bao gồm đồng phân mạch C với đồng phân địa chỉ nhóm OH.
- bí quyết tính số đồng phân:
6. Đồng phân ete:
- CTTQ của ete no, solo chức, mạch hở: Cn
H2n+2O (n ≥ 2).
- bí quyết tính số đồng phân:
7. Đồng phân phenol:
- CTTQ: Cn
H2n-6O (n ≥ 6)
- bí quyết tính nhanh:
8. Đồng phân anđehit:
- CTTQ của anđehit no, đối kháng chức, mạch hở: Cn
H2n
O (n ≥ 1). Trong phân tử đựng một nối song ở team chức CHO.
- công thức tính nhanh:
9. Đồng phân xeton:
- CTTQ của xeton no, solo chức, mạch hở: Cn
H2n
O (n ≥ 3). Vào phân tử chứ một nối đôi ở đội chức CO.
- bí quyết tính số đồng phân:
10. Đồng phân axit:
- CTTQ của axit no, đối kháng chức, mạch hở: Cn
H2n
O2 (n ≥ 1). Vào phân tử chứa một nối đôi ở nhóm chức COOH.
- bí quyết tính số đồng phân:
III. Các công thức hoá học lớp 11: phản bội ứng rứa Halogen
- Đây là bội phản ứng đặc thù của ankan.
1. Dẫn xuất monohalogen:
- Ankan + Halogen tỉ trọng 1 : 1 thu được dẫn xuất monohalogen.
- Yêu cầu của đề: xác minh công thức ankan
- PT:
hoặc
- Dữ kiện: đề bài xích sẽ cho %C, %H, tuyệt %Halogen.
- bí quyết tính:
Kết hợp với dữ kiện đề cho, tra cứu n.
- Sau khi xác định được CTPT, dựa vào số số lượng sản phẩm thế nhằm tìm CTCT của ankan. Khi phản ứng với halogen cho sản phẩm duy nhất, ankan đã là ankan đối xứng.
2. Dẫn xuất đi, tri...halogen:
- Ankan + Halogen tỉ lệ thành phần 1 : 2, 1 : 3, ...
- Yêu ước của đề: xác định công thức của dẫn xuất halogen.
- Dữ kiện: đề bài xích sẽ mang đến %C, %H, xuất xắc %Halogen với CTPT của ankan.
- PT:
- cách làm tính: (ví dụ cùng với ankan là C3H8)
Xác định x.
IV. Những công thức hoá học lớp 11: bội phản ứng cracking
- Phương trình:
Ankan Anken
hoặc (x + y = n)
Anken Ankan khác
Ví dụ:
- tự ankan đầu, sau làm phản ứng có thể thu nhiều chất sản phẩm.
- trọng lượng hỗn phù hợp trước và sau bội nghịch ứng ko đổi:
=> tuyệt
- Bảo toàn yếu tố C cùng H: khi đề bài cho đốt cháy các thành phần hỗn hợp sau làm phản ứng ta qui về đốt cháy tất cả hổn hợp trước bội phản ứng (một chất sẽ dễ dàng và đơn giản hơn các chất).
- Số mol lếu láo hợp:
Ví dụ:
1 1 1
=>
- hiệu suất phản ứng:
(Các công thức liên quan đến số mol ta rất có thể thay thế bằng thể tích).
V. Những công thức hoá học tập lớp 11: phản ứng cộng
- phản nghịch ứng cộng phá vỡ link π. Liên kết π là liên kết kết hèn bền, bắt buộc chúng dễ bị đứt ra để tạo nên thành liên kết những nguyên tử khác.
1. Cộng H2:
- chất xúc tác như: Ni, Pt, Pd, ở ánh nắng mặt trời thích hợp.
- Sơ đồ:
- PTTQ:
Với k là số liên kết π vào phân tử, 1π sẽ cùng với 1H2.
- Tùy vào hiệu suất và tỉ trọng của phản ứng mà tất cả hổn hợp Y rất có thể còn hiđrocacbon ko no dư hoặc hiđro dư hoặc cả hai còn dư.
- Trong bội nghịch ứng cộng H2, số mol khí sau làm phản ứng luôn luôn giảm (n
Y X) và bởi mol H2 làm phản ứng:
- Bảo toàn khối lượng:
- (luôn lớn hơn 1).
- hỗn hợp X và Y chỉ biến đổi về chất nhưng vẫn bảo toàn H với C, nên thay bởi đốt cháy Y ta có thể đốt cháy X. áp dụng định lý lẽ bảo toàn thành phần như việc đốt cháy.
-
a) Xét hiđrocacbon X là anken:- Sơ đồ:
- Phương trình:
- (= số mol khí giảm).
b) Xét hiđrocacbon X là anken:- Sơ đồ:
- Phương trình tổng quát:
-
2. Cùng brom:
- Phương trình:
- Công thức:
+ m bình tăng = m hiđrocacbon ko no
+ Vkhí bay ra = V hiđrocacbon no
+ nπ =
VI. Các công thức hoá học lớp 11: bài tập về phản ứng của ankin có liên kết ba đầu mạch với dung dịch Ag
NO3/NH3
- bội nghịch ứng xảy ra chỉ với ankin bao gồm nối ba đầu mạch (ank – 1 – in).
- PTTQ:
Kết tủa vàng
Phản ứng với tỉ lệ 1:1
- riêng với axetilen:
Phản ứng với tỉ lệ thành phần 1:2.
- gọi ,
+ k = 1: tất cả hổn hợp chỉ gồm ank – 1 – in,
+ 1 2H2 (hoặc ankin gồm 2 nối ba đầu mạch) với ank – 1 – in.
- Mkết tủa = Mankin + 107x (với x là số nối ba đầu mạch).
Các công thức hoá học tập lớp 11
Nếu nắm vững được các phản ứng và Các phương pháp hoá học lớp 11 trên đây, những em vẫn giải được những dạng bài bác tập về hiđrocacbon. Hãy luyện tập và áp dụng thật nhiều những em nhé!














