Thế nào là links pi và link xích ma. Họ hãy thuộc tìm làm rõ hơn thông qua bài viết sau nhé! Liên kết pi là 1 loại liên kết hình tròn trụ có chu vi bởi với hằng số pi (3,14). Liên kết pi được sử dụng trong những công trình ước để kết nối những phần mong với nhau, lấy ví dụ như các liên kết giữa những thanh cầu, những liên kết giữa những móng mong và đáy cầu. Bạn đang xem: Liên kết xích ma là gì Liên kết xích ma là một trong loại liên kết hình tròn có chu vi bằng với hằng số pi (3,14) với được sử dụng trong số công trình cầu để kết nối các phần cầu với nhau. Link xích ma được gia công từ thép hoặc nhôm và có thể được sử dụng trong những công trình cầu như những cầu ngầm, cầu nối, mong vượt, cầu hẹp và các cầu chỗ đông người khác. Liên kết xích ma hoàn toàn có thể được thực hiện để kết nối những phần cầu với nhau theo 1 phía ngang hoặc theo một phía dọc. Liên kết xích ma tất cả khả năng chịu lực tốt và có thể được sử dụng trong số công trình cầu có tương đối nhiều tải trọng. · Khi các nguyên tử sinh sống thật xa nhau tiến đến gần nhau tương tác thứ nhất xuất hiện nay là địa chỉ hút, mang đến một khoảng cách nhất định bước đầu xuất hiện can dự đẩy, khi tất cả sự cân đối giữa hai lực thì link hóa học tập hình thành. · link hóa học hình thành tương xứng với những nguyên tử phải thu xếp lại cấu trúc e những phân phần bên ngoài cùng làm thế nào để cho đạt tổng tích điện chung của hệ đề xuất hạ tốt xuống thì links mới bền, tức là khi tất cả sự sinh sản thành links thì quá trình phát sức nóng (ΔH 2. Bản chất liên kết hóa học: · links hóa học có bản chất điện vị cơ sở tạo nên thành liên kết là lực can dự giữa những hạt có điện (e tích năng lượng điện âm – phân tử nhân tích năng lượng điện dương). Bạn sẽ xem: bởi sao links xích ma bền hơn links pi

Hình 4.1. ảnh hưởng giữa các hạt mang điện · trong các tương tác hóa học chỉ có những e của các phân phần bên ngoài cùng thực hiện liên kết, đó là các e hóa trị. Các e hóa trị bên trong các AO hóa trị. · Theo cơ học lượng tử, nghiên cứu liên kết là phân tích sự phân bố mật độ e trong trường phân tử nhân của những nguyên tử tạo cho hợp chất. 3. Một số đặc trưng của liên kết: Những thông số kỹ thuật chính đặc trưng cho phân tử cùng cho links là độ dài liên kết, góc hóa trị và tích điện liên kết. v Độ dài link (l): | |
 |
Là khoảng cách giữa nhị hạt nhân của các nguyên tử thâm nhập liên kết. Độ dài liên kết thay đổi có qui cách thức và dựa vào vào: bản chất nguyên tử (kích thước, độ âm năng lượng điện ), kiểu link (đơn, đôi, ba).
v Góc hóa trị (góc liên kết)
:
Là góc hợp vì chưng hai đoạn trực tiếp nối hạt nhân nguyên tử trung chổ chính giữa với nhị hạt nhân nguyên tử liên kết. Góc hóa trị đổi khác có qui biện pháp và phụ thuộc vào:



Ø bản chất nguyên tử.
Ø loại liên kết. (H3C─CH3: CĈH = 109028’);
(H2C═CH2: CĈH = 1200); (HC≡CH: CĈH = 1800)
Ø làm nên học phân tử.
Ø ảnh hưởng đẩy giữa những đôi electron liên kết và không liên kết trong phân tử.
v Năng lượng liên kết:
Là tích điện cần tiêu tốn để tiêu diệt liên kết thành các nguyên tử xa lánh ở thể khí (hay cũng chính là năng lượng giải phóng ra khi tạo ra thành links từ những nguyên tử cô lập thể khí ban đầu ).
A─B(k) + EA─B A(k) + B(k) => EA─B = Ephân ly AB
ABn(k) + EABn A(k) + n
B(k) => ĒA─B =
EABn
Năng lượng liên kết nhờ vào vào độ nhiều năm liên kết, độ bội links (bậc liên kết) và chất lượng độ bền liên kết. Tín đồ ta nhận biết :*Bậc lk↑, E lk↑, chất lượng độ bền lk↑, độ dài lk↓.
II- LIÊN KẾT CỘNG HÓA TRỊ :
Có hai cách thức gần đúng để giải phương trình sóng Schrödinger mang đến hệ phân tử, mỗi cách thức do một nhóm tác giả chỉ dẫn hình thành một thuyết về link cộng hóa trị :
· Thuyết links hóa trị (VB: valence bond theory) (Heitler–London–Pauling): coi hàm sóng phân tử là tích số các hàm sóng nguyên tử.
· Thuyết orbital phân tử (MO: molecule orbital theory) (Mulliken): coi hàm sóng phân tử là phép tổ hợp cộng và trừ các hàm sóng nguyên tử.
các liên kết sigma (đại diện bởi) là 1 trong liên kết kiểu cùng hóa trị, được đặc thù bởi sự chia sẻ của hai năng lượng điện tử xẩy ra giữa một cặp nguyên tử để chế tạo thành liên kết này. Quanh đó ra, nó là một trong những lớp link đơn giản, vị trí hai nguyên tử được kết nối bởi hai năng lượng điện tử tạo thành thành một links đơn.
Hiển thị: links Sigma
Khi hai hoặc các nguyên tử kết phù hợp với nhau để tạo thành các hợp chất phân tử mới, bọn chúng được link với nhau bởi hai các loại liên kết: ion và cùng hóa trị, cấu trúc của chúng dựa vào vào cách chia sẻ các electron giữa chúng mà hai nguyên tử tham gia vào link này.
Liên kết được triển khai thông qua những electron được tiến hành nhờ sự xen phủ của những obitan thuộc mỗi nguyên tử (ở những đầu của chúng), được hiểu là các obitan của không khí nơi electron có tương đối nhiều khả năng cư trú nhất cùng được xác minh bởi tỷ lệ electron.
Mục lục
1 Nó được hình thành ra làm sao 1.1 Sự hình thành link Sigma trong những loài hóa học không giống nhau 2 Đặc điểm 3 lấy một ví dụ 4 tài liệu tìm hiểu thêm
Tóm Ý hide
1 Nó được hình thành như vậy nào?
2 Sự hình thành links sigma ở những loài hóa học không giống nhau
3 Đặc tính
4 ví dụ như
5 các tài liệu tìm hiểu thêm
6 bài bác chuyển hướng
Nó được hình thành như vậy nào?
Người ta thường xuyên biết rằng link đơn thân hai nguyên tử tương tự với links đơn của loại sigma.
Tương từ như vậy, những links này tạo nên từ sự xen lấp hoặc xen phủ trực diện xẩy ra giữa các đầu của obitan nguyên tử của hai nguyên tử khác nhau.
Các nguyên tử tất cả obitan trùng nhau đề nghị ở những vị trí lập tức kề, để những electron đơn côi thuộc từng obitan nguyên tử có thể hình thành liên kết kết quả và vì thế hình thành liên kết.
Từ kia dẫn đến thực tế là sự phân bố điện tử được thể hiện hoặc mật độ vị trí của những điện tử tạo ra từ mỗi chất chồng lên nhau, bao gồm một dạng đối xứng xung quanh trục xảy ra giữa hai các loại nguyên tử liên kết.
Trong trường thích hợp này, dòng gọi là tiến trình sigma có thể được biểu thị dễ dàng rộng bằng các liên kết nội phân tử được hình thành trong số phân tử tảo cát, lưu ý rằng cũng có thể có một số loại link sigma.
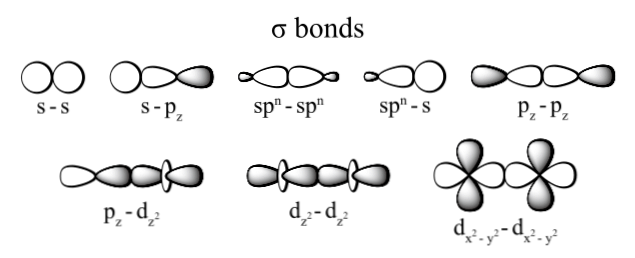
Các loại liên kết sigma hay được quan tiếp giáp là: dz2 + dz2, s + pz, pz + pz và s + s; trong các số ấy chỉ số z thay mặt đại diện cho trục được có mặt bởi link hình thành và mỗi chữ cái, s, p. Và d) tương xứng với một quỹ đạo.
Sự hình thành links sigma ở các loài hóa học khác nhau
Khi chúng ta nói về những obitan phân tử, họ đang kể đến những vùng tích tụ mật độ electron tối đa khi một link như vậy ra đời giữa những phân tử khác nhau, đạt được bằng cách kết hợp những obitan nguyên tử.
Theo quan điểm của cơ học lượng tử, các nghiên cứu và phân tích đã suy ra rằng những obitan nhiều loại phân tử gồm đối xứng bằng lize.vn được kết hợp tốt trong hỗn hợp (lai hóa).
Tuy nhiên, superlize.vnt của sự phối kết hợp các obitan này còn có liên quan nghiêm ngặt đến năng lượng tương đối tính được biểu diễn bởi các obitan thuộc nhiều loại phân tử tương tự đối xứng.
Trong trường hòa hợp phân tử hữu cơ, fan ta thường quan giáp thấy các loài mạch vòng gồm 1 hoặc nhiều cấu trúc mạch vòng, thường được cấu trúc bởi một trong những lượng lớn link loại sigma kết phù hợp với liên kết các loại pi (nhiều liên kết).
Trong thực tế, sử dụng những phép đo lường học đơn giản, rất có thể xác định được số lượng liên kết sigma có trong một loại phân tử.
Cũng gồm trường hợp các hợp hóa học phối trí (với các kim loại chuyển tiếp), chúng phối hợp nhiều liên kết với các kiểu tương tác links khác nhau, cũng tương tự các phân tử được sản xuất thành từ các loại nguyên tử không giống nhau (đa nguyên tử).
Đặc tính
Liên kết sigma bao gồm đặc điểm biệt lập giúp phân biệt cụ thể chúng với những loại liên kết cộng hóa trị không giống (liên kết pi), trong đó thực tiễn là loại links này là bạo gan nhất trong những các loại links cộng hóa trị.
Điều này là do sự xen che giữa những obitan xảy ra trực tiếp, đồng trục (hoặc tuyến đường tính) cùng phía trước; nghĩa là gồm sự xen phủ cực to giữa các obitan.
Hơn nữa, sự phân bố của các điện tử trong số liên vừa lòng này triệu tập chủ yếu ớt giữa các hạt nhân của các nguyên tử loại kết hợp.
Sự xen phủ của các obitan sigma xảy ra theo bố cách có thể xảy ra: giữa một cặp obitan đơn thuần (ss), thân obitan thuần túy với obitan lai (s-sp), hoặc giữa một cặp obitan lai hóa (sp3-sp3).
Sự lai hóa xảy ra thông sang một hỗn hợp các obitan có xuất phát nguyên tử của các lớp khác nhau, thu được rằng obitan lai hóa dựa vào vào số lượng của từng các loại obitan ban sơ thuần túy (ví dụ: sp3 = một obitan s thuần + bố obitan loại p thuần túy).
Ngoài ra, link sigma hoàn toàn có thể tồn tại chủ quyền và mang định chuyển động tự vị giữa một cặp nguyên tử.
Ví dụ
Vì links cộng hóa trị là một số loại liên kết thịnh hành nhất giữa các nguyên tử, nên links sigma được tra cứu thấy trong một trong những lượng lớn những loại hóa chất, như có thể thấy bên dưới.
Trong phân tử khí diatomic – ví dụ như hydro (H2), oxy (O2) cùng nitơ (N2) – hoàn toàn có thể trình bày các loại liên kết khác biệt tùy trực thuộc vào sự lai hóa của các nguyên tử.
Trong trường phù hợp của hydro, tất cả một liên kết sigma tuyệt nhất nối nhì nguyên tử (H – H), do mỗi nguyên tử mang một điện tử duy nhất của nó.
Mặt khác, vào ôxy phân tử, nhì nguyên tử được liên kết với nhau bởi một liên kết đôi (O = O) – có nghĩa là một links sigma – và một link pi, để lại cho mỗi nguyên tử có cha cặp electron khớp với nhau. .
Thay vào đó, từng nguyên tử nitơ có năm năng lượng điện tử làm việc mức năng lượng ngoài cùng của nó (vỏ hóa trị), do vậy bọn chúng được kết nối với nhau bằng một link ba (N≡N), ngụ ý sự hiện hữu của một liên kết sigma với hai link pi với một link đôi của các điện tử ghép đôi trong những nguyên tử.
Tương từ bỏ như vậy, nó xảy ra trong các hợp chất thuộc các loại mạch vòng có liên kết đơn hoặc nhiều link và trong toàn bộ các một số loại phân tử bao gồm cấu trúc bao gồm các link cộng hóa trị.
Các tư liệu tham khảo
Wikipedia. (sf). Các liên kết Sigma. Lấy từ en.wikipedia.org
Chang, R. (2007). Hóa học, ấn phiên bản thứ chín. Mexico: Mc
Graw Hill.Think
Co. (sf). Định nghĩa hóa học links Sigma. đem từ thinkco.com
Britannica, E. (sf). Các liên kết Sigma. Mang từ britannica.com
Libre
Texts. (sf). Links Sigma và Pi rước từ chem.libretexts.org Srivastava, AK (2008). Chất hóa học hữu cơ 1-1 giản. Lấy từ books.google.com.vn














